アミノ酸「システイン」が細胞を元気づけて細胞の成長を促すメカニズムの詳細を解明 大阪大学
アミノ酸の一種のシステインがPib2タンパク質により感知されることで、TORC1と呼ばれるタンパク質が活性化して、細胞の成長が促進されるとする研究結果が報告された。大阪大学の研究グループによる研究であり、「Cell Reports」に論文が掲載されるとともに、同大学のサイトにプレスリリースが掲載された。

研究グループによると、TORC1はアミノ酸などに応答して細胞の成長を促し、それらが枯渇するとオートファジーなどの分解を誘導するスイッチとして機能することが知られていたが、これまで酵母細胞において20種類のアミノ酸がどのようにTORC1を活性化するかについては詳細に解明されていなかったという。
研究の概要:アミノ酸が細胞へ働きかる仕組みを解明
細胞はアミノ酸などの栄養源の存在を感知し、TORC1(target of rapamycin complex 1)と呼ばれるタンパク質キナーゼ複合体※1が活性化して、タンパク質や脂質の合成を促進することで細胞が増殖する。一方、栄養がなくなるとTORC1は不活性化し、オートファジー※2などの分解過程が始まる。これらのことより、TORC1は細胞の成長やオートファジーに関するスイッチのように働くと考えられている。
※1 タンパク質キナーゼ複合体:タンパク質キナーゼは細胞の中の信号の伝達に関わる。活性化することにより標的のタンパク質にリン酸基を付加しその役割を調節することで信号が伝達される。複合体は複数のタンパク質から構成されることを示す。
※2 オートファジー:栄養が枯渇した時などに、細胞が自分自身の構成成分を一部分解する現象。
これまで酵母では、生体内で利用される20種類のアミノ酸が、どのようにTORC1を活性化するかについては詳細に解明されていなかった。今回、研究グループは、さまざまなアミノ酸がTORC1に影響する経路を分析することにより、システインがPib2タンパク質に直接結合し、TORC1を活性化することを解明した。これにより、アミノ酸がどのように細胞に利用されるかの理解が深まることが期待される。
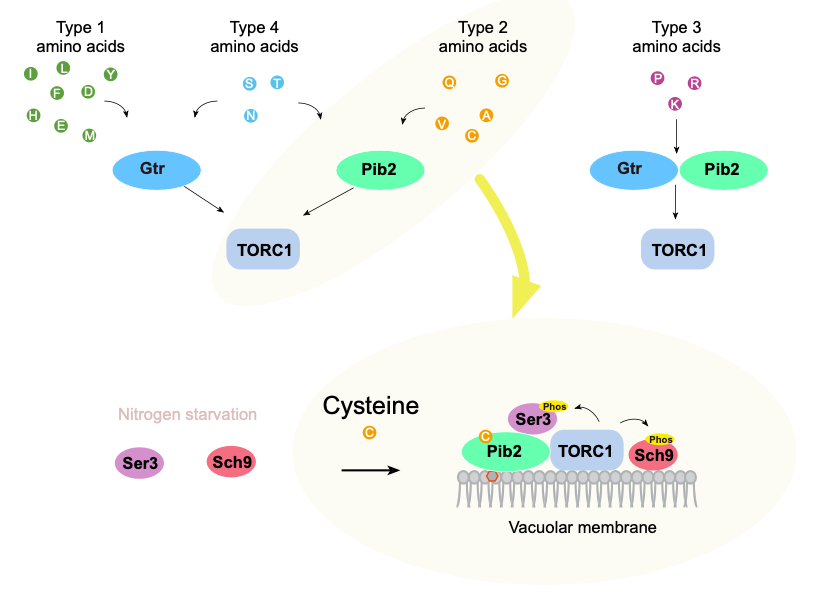
図 アミノ酸がTORC1を活性化する経路
研究の背景:アミノ酸がどのようにTORC1に感知されるか
TORC1はアミノ酸などに応答して細胞の成長を促し、それらが枯渇するとオートファジーなどの分解を誘導するスイッチとして機能することが知られていた。TORC1は、ヒトなどの哺乳類から酵母のような生物まで保存された共通性の高い基本的な細胞の仕組みだが、とくに酵母において、アミノ酸がどのようにTORC1に感知されるか不明な点が多く残されていた。これまで、酵母におけるTORC1のアミノ酸による活性化には、Gtr経路とPib2経路という2種類の経路が関与することがわかっていた。
研究の内容:システインはPib2タンパク質に直接結合してTORC1を活性化する
研究グループは、生体が利用する20種類のアミノ酸と、Gtr経路とPib2経路の2種類の経路の間の関係性を調べた。その結果、それぞれのアミノ酸は2種類の経路を使い分けながらTORC1を活性化することがわかった。
タイプ1のアミノ酸(ロイシン、メチオニン等)は主にGtr経路を利用していた。タイプ2のアミノ酸(システイン、グルタミン等)は主にPib2経路を利用していた。タイプ3のアミノ酸(プロリン、リジン等)はGtr経路とPib2両方を利用していた。タイプ4のアミノ酸(セリン、アスパラギン等)はGtr経路とPib2経路のいずれかを利用していた。
そのなかでも、システインはPib2タンパク質に直接結合し、そのことによりPib2とTORC1の間の相互作用が強まり、TORC1を活性化することを明らかにした。
本研究成果の意義:アミノ酸のさらなる理解に期待
アミノ酸は体を構成するタンパク質の部品であり、さまざまな生理作用に深く影響する。その存在状況は精緻に感知されており、その破綻はがんなどに結びつくことも知られている。本研究成果により、それぞれのアミノ酸が細胞でどのように感知されTORC1による細胞成長を促すかについて、理解が深まることが期待される。
プレスリリース
アミノ酸 システインが細胞を元気づける! 細胞の成長スイッチ“TORC1”が活性化する仕組みの解明(大阪大学)
文献情報
原題のタイトルは、「Pib2 is a cysteine sensor involved in TORC1 activation in Saccharomyces cerevisiae」。〔Cell Rep. 2023 Dec 20;43(1):113599〕
原文はこちら(Elsevier)






















 熱中症予防情報
熱中症予防情報 SNDJユニフォーム注文受付中!
SNDJユニフォーム注文受付中!