父親の食生活が子どもの生活習慣病発症に関係? 胎児プログラミング仮説の一端を解明
親の世代の栄養状態が子どもの疾患、とくに糖尿病などの生活習慣病の発症頻度に影響するという「胎児プログラミング仮説」の一端が明らかになった。理化学研究所の研究員らによる国際研究グループによる研究論文が「Molecular Cell」に発表されるとともに、同研究所のWebサイトにニュースリリースが掲載された。

胎児プログラミング仮説とは、疫学研究から示されている、低出生体重児は成人後に糖尿病などの生活習慣病の発症リスクが高いという結果をもとに立てられた、「将来の健康や疾患発症リスクは、胎児期や生後早期の環境の影響を受けて決定される」という仮説。 食物やストレスなどの後天的な要因によって起きる、DNA塩基配列の変化を伴わない「エピゲノムな変化※1」が、疾患発症のリスクに影響すると考えられている。そして、このエピゲノム変化は、食習慣やストレスの負荷の影響を受けた人だけでなく、その次世代に遺伝し得ることが今、トピックになっている。
※1 エピゲノム:接頭辞「エピ(付加したの意)」と「ゲノム」をつないだ言葉で、DNAやDNAが巻き付くヒストンタンパク質がメチル化など化学修飾された遺伝子配列情報のこと。エピゲノムのいくつかは細胞分裂を越えて伝わる。また、エピゲノムは環境要因により変化し、それがさまざまな疾患の発症に影響することが示唆されている。
胎児プログラミング仮説とエピゲノム
胎児プログラミング仮説は、マウスなどの実験動物を用いて分子生物学的には実証されている。この現象は頻度が高いことから、発現頻度が低いDNA変異によるものではなく、何らかのエピゲノム変化が生じて、それが遺伝することに起因すると推定されている。しかし、そのメカニズムは明らかになっていなかった。
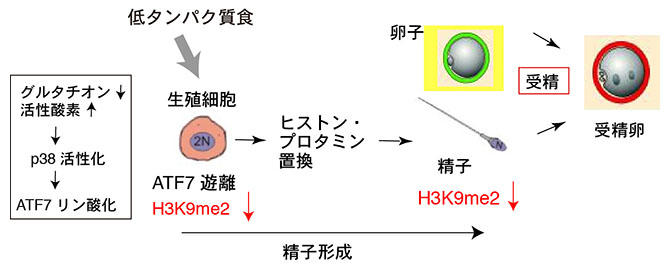
今回発表された研究では、野生型雄マウスに低タンパク質食を与えると、その子どもの肝臓でコレステロール代謝系遺伝子などの発現が変化するのに対して、転写因子ATF7※2、3のヘテロ変異体※4の雄マウスが父親の場合には、子どもに遺伝子発現変化が起こらないことがわかった。さらにこのメカニズムとして、低タンパク質食を与えると雄の精巣の生殖細胞でATF7がリン酸化され標的遺伝子から遊離することで、エピゲノム変化(ヒストンH3K9のジメチル化※5レベルの低下)が起こり、この変化が精子を経て受精卵に伝わり、遺伝子発現変化を誘導することが明らかになった(図1)。
※2 転写因子:DNAに配列特異的に結合するタンパク質で、プロモーターやエンハンサーといった転写制御領域に結合し、RNAポリメラーゼによる遺伝子の転写を活性化あるいは不活性化する。
※3 ATF7:30年前に今回の研究グループのメンバーらにより同定されたATF2と構造が類似した転写因子。ATF2やATF7は多様なストレスに呼応して、ストレス応答性リン酸化酵素p38でリン酸化されるという特徴をもつ。
※4 ヘテロ変異体:2つのゲノムのうちの1つだけが変異を持つ個体。したがって、ATF7ヘテロ変異体でのATF7の量は野生型の半分になっている。ヘテロ変異体雄マウスを野生型雌と交配させると、ヘテロ変異体と野生型の子供が生まれる。
※5 ヒストンH3K9のジメチル化:ヒストンH3のN末端から9番目のリジン(K)のジメチル化(H3K9me2)のこと。H3K9me2は転写が不活発で、固い安定なクロマチン構造を形成する。このような構造は、体細胞分裂や生殖細胞での減数分裂を経ても安定に維持される。
図1 父親の食事が生殖細胞でのエピゲノム変化を誘導し子どもに影響するメカニズム
研究手法と成果
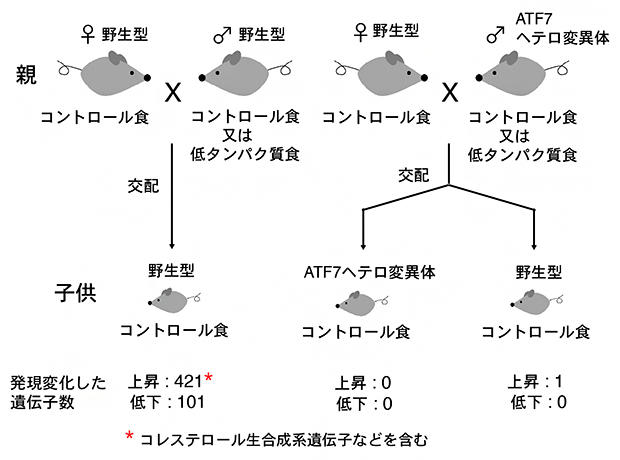
研究グループでは、野生型の雄マウスを低タンパク質食またはコントロール食で飼育。コントロール食で飼育した野生型雌マウスと交配して、生まれた子どもの肝臓における遺伝子発現パターンを調べた。
その結果、雄マウスを低タンパク質食で飼育した場合には、コントロール食で飼育した場合に比べ、421個の遺伝子の発現上昇と101個の遺伝子の発現低下が観察された(図2左)。発現上昇する遺伝子にはコレステロール代謝系遺伝子などが多く含まれ、父親の低タンパク質食は子どもの代謝系に影響することが示された。
一方、ATF7ヘテロ変異マウスを父親として用いた場合は、ATF7ヘテロ変異体と野生型の子どもが生まれるが、いずれの場合も低タンパク質食によって発現が変化する遺伝子はほとんどなかった(図2右)。これにより、父親の低タンパク質食が子どもに影響する現象にはATF7が必須であることがわかった。
図2 父親マウスの低タンパク質食による子どもマウス肝臓での遺伝子発現変化
次に、低タンパク質食がATF7にどのように影響するかを調べたところ、父親の精巣の生殖細胞では、グルタチオン濃度が低下、活性酸素濃度が上昇した結果、ストレス応答性リン酸化酵素p38が活性化され、ATF7がリン酸化されることがわかった。グルタチオンはアミノ酸のシステインを含む小さなペプチドで、細胞内の活性酸素を還元して無毒化する役割を担っている。低タンパク質食はシステイン含有量が少ないため、グルタチオン濃度の低下に伴い活性酸素を還元する能力が低下し、活性酸素濃度が上昇したと考えられる。
また、生殖細胞におけるATF7結合遺伝子を解析した結果、ATF7はゲノム上の約3,500カ所に結合し、多くは遺伝子の転写を制御するプロモーター領域※6に結合していることがわかった。そして低タンパク質食によって80%のATF7結合部位からATF7が遊離し、代表的なATF7結合遺伝子上では、H3K9ジメチル(H3K9me2)レベルの低下(エピゲノム変化)が見られた(図3)。
※6 プロモーター領域:ゲノムDNA上でRNAに転写される領域の一番上流にあり、遺伝子を発現させる機能をもつ部分をプロモーター領域(配列)という。
図3 父親マウスの生殖細胞でのATF7結合遺伝子の解析
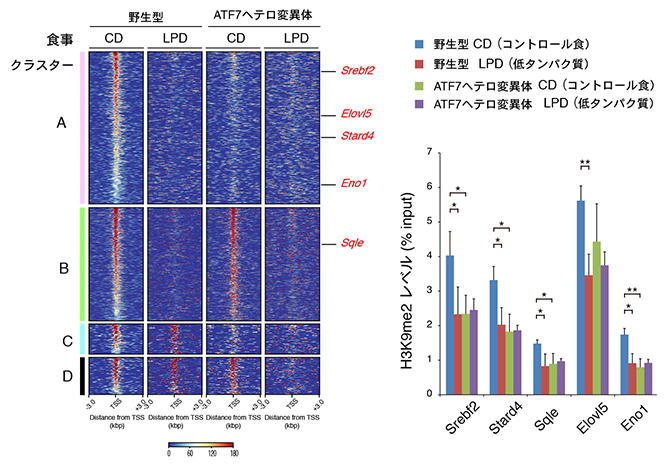
右:生殖細胞での代表的な5つのATF7結合遺伝子上のH3K9me2レベルをqChIP法で調べた。野生型低タンパク質食では、コントロール食に比べてH3K9me2レベルが低下した。
精子が形成される過程では、ほとんどのヒストンは精子固有の核タンパク質プロタミンで置換されるが、完全に成熟した精子にはごく少量のヒストンが残っており、生殖細胞の ATF7結合遺伝子上のヒストンは精子になっても残りやすいことがわかった(図4左)。また、低タンパク質食によって低下した生殖細胞のATF7結合遺伝子上のH3K9me2レベルは、精子になっても低下したまま保持されることが示された(図4右)。
図4 精子でのATF7結合遺伝子の解析
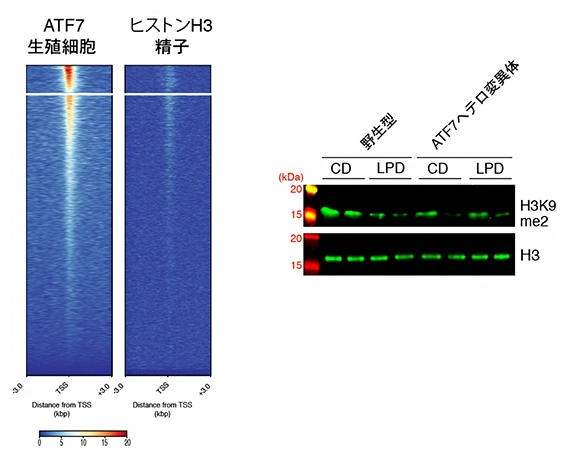
右:精子のヒストンH3レベルとH3K9me2レベルをウェスタンブロットで解析した。野生型低タンパク質食(WTLCD)とATF7ヘテロ変異体コントロール食(CD)・低タンパク質食(LPD)でH3K9me2レベルが低下した。
米国の研究グループの最近の報告で、低タンパク質食により精子中の転移RNA(tRNA)※7分解フラグメントの量が増加し、それが次世代に伝わり、遺伝子発現を変化させる可能性が示されている。
※7 tRNA:転移リボ核酸(transfer RNA)のこと。アミノ酸の種類ごとに、1から数種類のtRNAが存在する。tRNAはそれぞれ対応するアミノ酸を末端に結合し、リボソームまで運搬する。リボソームにアミノ酸を受け渡すと、再びアミノ酸を結合して、リボソームまで運搬する働きを繰り返す。
そこで、ATF7のゲノム上の結合部位を調べたところ、生殖細胞ではいくつかのtRNA遺伝子にATF7が結合しており、低タンパク質食により、これらtRNA遺伝子からATF7が遊離し、H3K9me2レベルが低下、tRNA量が増加することがわかった(図5)。こうして増加したtRNAが精子形成過程で分解され、精子中のフラグメント量が増加すると考えられる。
図5 生殖細胞におけるtRNA遺伝子のATF7による制御
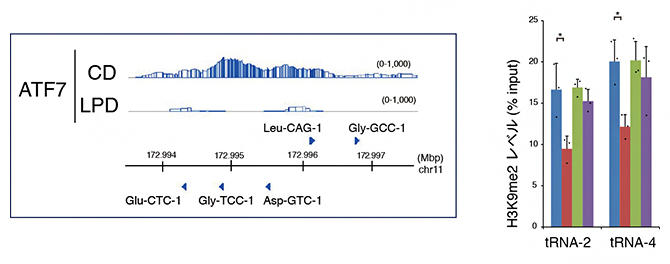
右:この領域のH3K9m2レベルをqChIP法で解析した。低タンパク質食により、H3K9m2レベルが低下する。
以上のように、低タンパク質食は雄の生殖細胞において、ATF7結合遺伝子からのATF7の遊離、H3K9me2レベルの低下を誘導し、それが精子を通じて受精卵に伝わり、子どもの遺伝子発現を変化させることが示された。また、ATF7結合遺伝子にはいくつかのtRNA遺伝子も含まれ、低タンパク質食はATF7を介してtRNA量とtRNA分解フラグメント量を増加させ、それが受精卵に伝わることもメカニズムの一端と考えられる。
今後の期待
以上一連の結果から研究グループは、「本研究により、『親の食事が子供の成人病などの疾患発症に影響する』という胎児プログラミング仮説のメカニズムの一端が解明され、どのような栄養条件が子どもの世代の生活習慣病の発症に影響するかを科学的に解明する手掛かりが得られた。今後、より健康的な栄養条件の解明やサプリメントなどの開発につながると考えられる」とまとめている。また、「生殖細胞でエピゲノム変化が誘導される遺伝子群が同定されたことにより、これらの遺伝子のエピゲノム変化を測定することで、次世代での代謝変化を予測することも可能になると期待できる」としている。
プレスリリース
父親の食事が子供の代謝に影響するメカニズムを解明(理化学研究所)
文献情報
原題のタイトルは、「ATF7-dependent epigenetic change is required for intergenerational effect of paternal low-protein diet」。〔Mol Cell. 2020 Mar 17. pii: S1097-2765(20)30148-9〕
原文はこちら(Elsevier)





















 熱中症予防情報
熱中症予防情報 SNDJユニフォーム注文受付中!
SNDJユニフォーム注文受付中!